ミニレビュー
がんに対する前哨基地: 万能のがん専用マーカー
Chengchen Qian1, Xiaolong Zou2, Wei Li1,3, yingshan Li4, Wenqiang Yu5
1Shanghai Epiprobe Biotechnology Co., Ltd、上海 200233、中国;2 ハルビン医科大学第一付属病院一般外科、ハルビン150001、中国。3Shandong Epiprobe Medical Laboratory Co., Ltd、菏沢274108、中国;4 寧夏回族自治区人民病院、寧夏医科大学、銀川、750002、中国;5 上海公衆衛生臨床センター & 一般外科、華山病院 & 癌転移研究所 & RNA エピジェネティクス研究室、生物医科学研究所、上海医科大学、復旦大学、上海 200032、中国
抽象的な
がんは世界中で主な死因となっています。がんを早期に発見すると、あらゆる種類のがんの死亡率を下げることができます。しかし、ほとんどの種類のがんでは、効果的な早期検出バイオマーカーが不足しています。DNA メチル化は通常、他の検出可能な遺伝子変化の前に起こるため、DNA メチル化は常に主要な関心対象となっています。DNA メチル化のための新しいガイド位置決めシーケンスを使用してがんの共通の特徴を調査する中で、一連のユニバーサルがん専用マーカー (UCOM) ががんの効果的かつ正確な早期検出のための強力な候補として浮上しました。現在のがんバイオマーカーの臨床的価値は感度の低さや特異度の低さによって低下しますが、UCOM の独自の特性により臨床的に意味のある結果が保証されます。肺がん、子宮頸がん、子宮内膜がん、および尿路上皮がんにおける UCOM の臨床的可能性の検証により、複数のがんの種類およびさまざまな臨床シナリオにおける UCOM の適用がさらに裏付けられます。実際、UCOM の応用は現在、がんの早期発見、補助診断、治療効果、再発モニタリングにおけるさらなる評価を目的として積極的に研究されています。UCOM ががんを検出する分子機構は、次に研究されるべき重要なトピックです。現実世界のシナリオで UCOM を適用するには、実装と改良も必要です。
キーワード
がんの検出。がん検診。DNAメチル化;がんのエピジェネティクス。がんバイオマーカー
新しいものが早急に必要な理由 バイオマーカー?
1世紀以上にわたってがんと闘ってきたが、がんは依然として人類にとって最も致命的な生物学的脅威である。がんは依然として世界的な健康上の懸念であり、2020 年には新たに 1,930 万人が罹患し、1,000 万人近くが死亡すると推定されています1。2020 年には中国で推計 460 万人が新たにがんと診断され、GLOBOCAN1 によると世界の新規がん症例の 23.7% を占めています。さらに、2020 年には中国では約 300 万人ががんによる死亡とされており、これは世界のがん関連死亡の 30% に相当します1。これらの統計は、中国ががんの罹患率と死亡率で第一位にあることを示した。さらに、がんの 5 年生存率は 40.5% であり、米国の 5 年生存率より 1.5 倍低いです 2,3。人間開発指数が高い国に比べて中国の生存率が比較的低く、死亡率が高いことは、効率的で費用対効果の高いがんの予防と監視システムが緊急に必要であることを示唆しています。がんの早期発見は、医療システムにおいて最も重要な要素の 1 つです。がんを早期に検出すると、ほぼすべての種類のがんにおいて、早期段階での予後と生存率が向上します4。スクリーニング戦略の成功により、子宮頸がん、乳がん、結腸直腸がん、および前立腺がんの発生率と死亡率が大幅に減少しました。
しかしながら、がんの早期発見を達成することは容易なことではない。早期がんの生物学と予後を調査し、信頼できる早期検出バイオマーカーを特定および検証し、利用可能で正確な早期検出技術を開発することは、常にプロセスにおける最大の障害でした。がんを正確に検出すると、良性病変と悪性病変を区別できるため、不必要な処置を回避し、さらなる疾患管理が容易になります。現在の早期発見戦略には、内視鏡ベースの生検、医療画像検査、細胞学、イムノアッセイ、およびバイオマーカー検査が含まれます5-7。内視鏡による生検は煩雑で費用がかかるため、専門スタッフに依存する主要な医療処置として本質的に大きな負担が伴います。細胞学と同様に、どちらのスクリーニング方法も医療専門家に依存しており、個人的な判断に基づいており、そのパフォーマンスは理想とは程遠い8。対照的に、イムノアッセイは偽陽性率が高いため、非常に不正確です。スクリーニング戦術としての医療画像処理には、高価な機器と専門の技術者が必要です。したがって、アクセシビリティが低いため、医療用画像処理は非常に制限されています。これらすべての理由から、バイオマーカーはがんの早期発見にはより良い選択肢であると考えられます。
対応者: yingshan li 氏と Wenqiang Yu 氏
Email: liyinshan@nxrmyy.com and wenqiangyu@fudan.edu.cn
ORCID ID: https://orcid.org/0009-0005-3340-6802 および
https://orcid.org/0000-0001-9920-1133
2023 年 8 月 22 日に受領。2023 年 10 月 12 日に受理されました。
2023 年 11 月 28 日にオンラインで公開されました。
www.cancerbiomed.org で入手可能
©2023 がんの生物学と医学。クリエイティブ・コモンズ
表示 - 非営利 4.0 国際ライセンス
バイオマーカーは現在、タンパク質、DNA 変異マーカー、エピジェネティックマーカー、染色体異常、腫瘍に直接由来する RNA マーカー、または体液から間接的に得られる腫瘍断片に分類されています。タンパク質マーカーは、がんのスクリーニングと診断に最も広く適用されているバイオマーカーです。スクリーニングバイオマーカーとしてのタンパク質バイオマーカーは、αフェトプロテインや前立腺特異抗原(PSA)について報告されているように、良性病変の影響を受ける傾向があるため限界があり、過剰診断や過剰治療につながる9,10。RNA マーカーには、遺伝子発現パターンおよびその他の非コード RNA マーカーが含まれます。遺伝子発現 RNA マーカーの組み合わせは、尿サンプルを使用して検出できますが、その感度は原発腫瘍では満足のいくもの (60%) とは程遠いものでしたが、その検出は可能でした。通常の環境では RNA の分解されやすい性質の影響を受けます 11。遺伝的マーカーとエピジェネティック マーカーはどちらも、腫瘍の蔓延と癌の種類の限定という問題に直面しています。
DNA メチル化は、1983 年に Feinberg によって初めて癌と関連付けられて以来、早期検出バイオマーカーとして有力な候補となってきました 12。DNA メチル化異常は、前癌段階から癌のすべての段階で観察されます。異常な DNA 過剰メチル化は通常、腫瘍抑制因子に対抗するために遺伝子プロモーターの CpG アイランドで起こります 13,14。研究では、異常な DNA 過剰メチル化が発達調節因子の上方制御に関与していることも示唆されています 15。一般に発生制御因子や過剰メチル化がんに関連する DNA メチル化バレーは、遺伝子発現モードをより安定な DNA メチル化依存モードに切り替え、メチル化ヒストン H3K27me3 および関連するポリコームタンパク質との結合を減少させる可能性があります 16,17。
多数の公開された DNA メチル化マーカーの中には、市場でのデビューに成功したものもあります。しかし、現在市販されている DNA メチル化マーカーと診断パネルは、複数の理由により、がんの早期検出の可能性をまだ完全には解き放っていません 18。データベース情報を使用すると、これらのバイオマーカーはほとんどの場合許容可能なパフォーマンスを示しますが、現実世界のサンプルは多くの場合より複雑であり、データベースで選択されたサンプルほど代表的ではないという事実により、現実世界では通常、理想的なパフォーマンスとは異なります。次世代シーケンスに基づく複数のがんメチル化早期検出の感度は、ステージ I および II のがんにおいてそれぞれわずか 16.8% および 40.4% であることが示されています 19。早期検出テストには、より優れた安定性とより正確なバイオマーカーが必要です。
ガイド ポジショニング シーケンス (GPS) を使用したユニバーサル ガンオンリー マーカー (UCOM) の検出
何十年にもわたってがん研究が行われてきたにもかかわらず、満足のいく予防と治療は実現されていません。研究者ががんを徹底的に評価できるようにするには、新しい方法論が必要です。過去 23 年間で、アポトーシスの回避、組織浸潤および転移などの 6 つのがんの特徴は、非変異エピジェネティックな再プログラミングや多型マイクロバイオームなどの特徴を含めることにより 14 に拡張されました 20,21。がんに関するさらなる詳細が明らかになるにつれて、がん研究により多くの視点が導入されています。がん研究は2つの方向(共通性と個別性)で徐々に新しい時代を迎えています。近年の高精度腫瘍学の発展により、がん研究の焦点は個別化された標的療法とがんの不均一性に傾いています22。したがって、最近同定されたがんバイオマーカーは、PAX6 子宮頸がん 23 や結腸直腸がんの BMP3 24 など、主に特定のがんの種類に焦点を当てています。がんの種類に特有のこれらのバイオマーカーの性能はさまざまですが、生物学的サンプルの取得には限界があり、コストが高いため、影響を受けやすい人がすべてのがんのスクリーニングを同時に受けるのは依然として不可能です。あらゆる種類のがんに有効な単一の強力なバイオマーカーを初期段階で特定できれば理想的です。
このような理想的な目標を達成するには、潜在的なバイオマーカーの種類のリストからより優れたバイオマーカー候補を選択する必要があります。すべての遺伝的およびエピジェネティックなプロファイルの中でも、DNA メチル化異常はがんに関連することが知られており、年代順に最初ではないにしても、最も初期に発生するがん関連異常の一部です。DNA メチル化の研究は早期に開始されましたが、研究方法の欠如によって妨げられてきました。腫瘍形成をよりよく理解するには、ゲノム内の 2,800 万個の潜在的なメチル化 CpG 部位のうち、管理可能な数を検出し、ゲノムと位置合わせする必要があります。DNA メチル化シーケンスのゴールドスタンダードと考えられている全ゲノム重亜硫酸塩シーケンス (WGBS) は、DNA 断片を破壊してゲノムの複雑性を低下させるという重亜硫酸塩処理の性質により、がん細胞内の Cs の 50% しかカバーできません。 Cs から Ts25 への変換。450k チップなどの他の方法では、ゲノムメチル化の 1.6% しかカバーできません。450,000 のデータに基づくと、DNA メチル化検出パネルは 6 種類のステージ I がんに対して 35.4% の感度を持っています 26。がんの種類の制限、パフォーマンスの低下、分析プロセスの検出方法によって生成されるノイズが、汎がん検出パネルにとって最大の障害となっています。
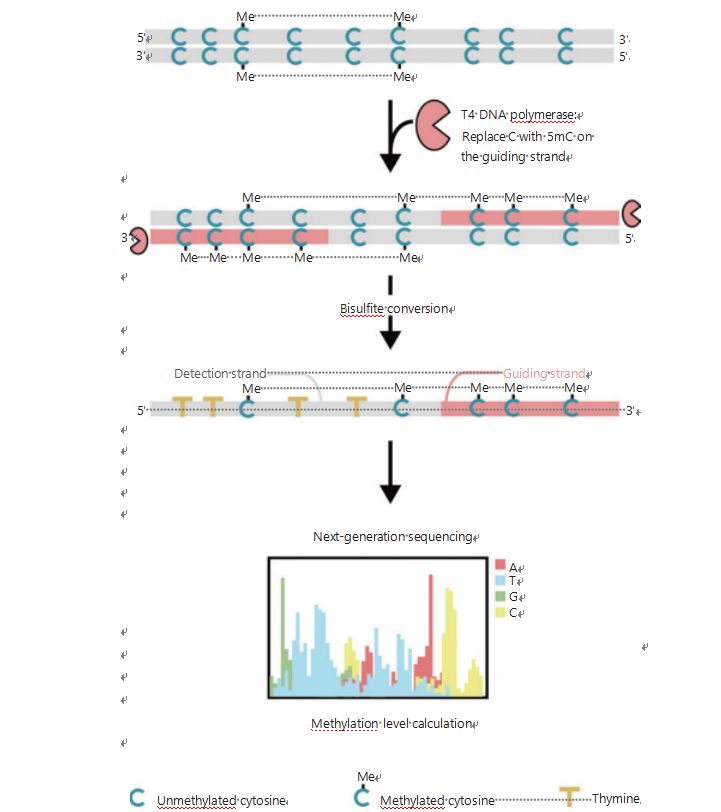
腫瘍形成および転移中の細胞のエピジェネティック パターンをより詳しく調査するために、ゲノム全体の DNA メチル化検出用の独自の GPS を開発しました。この GPS は、4 億リードで CpG 部位の最大 96% をカバーします 25。GPS は、重亜硫酸塩処理後の非変換メチルシトシンの DNA フラグメントの 3' 末端を使用する両側シーケンス法であり、ペアエンドシーケンスによる 5' 末端の DNA メチル化計算のアライメントをガイドします (図 1)25。テンプレート鎖として機能するメチルシトシンガイド鎖は、従来の WGBS で最も放棄されていた配列決定データを回復する高 GC 領域のアライメントを支援します。GPS の高いカバー率機能により、膨大な量の DNA メチル化情報が得られるため、これまで調査が不十分だった領域において、かなり高い解像度でがんのメチル化プロファイルを調べることが可能になります。
GPS は、がんの均一性を調査するための強力なツールを提供します。これにより、がん研究が大幅に簡素化され、腫瘍の発生と転移の普遍的な説明が見つかる可能性があります。がん細胞株のGPSデータを解析していると、特有の現象が頻繁に発生しました。複数の種類のがんサンプルには、異常に過剰メチル化されているように見える領域が多数ありました。この予期せぬ発見は、その後、UCOM として機能することが検証されました。The Cancer Genome Atlas (TCGA) データベースにある 17 種類の癌からの 7,000 を超えるサンプルが分析され、その中で、すべての種類の癌で過剰メチル化されているヒストン関連遺伝子である最初の UCOM、HIST1H4F が特定されました 27。その後、TCGA データベース、遺伝子発現オムニバス (GEO) データベース、および実際の臨床サンプルで一連の UCOM が発見され、検証されました。現時点では、HIST1H4F、PCDHGB7、および SIX6 が UCOM として検出され、検証されています。UCOM の予期せぬ発見は、がんの早期発見の必要性に対する強力な答えを提供します。UCOM は、複数のがんを単一マーカーで検出するためのソリューションを提供します。
UCOMの特徴
検証の結果、UCOM は現在のバイオマーカーの有効性を上回る 4 つの主要な特性を示すことが示されました (図 2)。
悪性腫瘍に特有の
UCOM はがん性または前がん性病変に特有のものであり、通常の生理学的変化の影響を受けません。早期発見および/またはスクリーニングに広く適用されている現在のがん関連マーカーの中には、過剰診断を引き起こしているものもあります。臨床的に認定されたスクリーニングツールである PSA レベルの上昇は、前立腺過形成や前立腺炎などの良性疾患でも検出されます10。過剰診断とその結果としての過剰治療は、腸、泌尿器、性的合併症による生活の質の低下につながります28。CA-125 など、臨床現場で広く使用されている他のタンパク質ベースのバイオマーカーは、過剰診断や過剰治療を引き起こす一方で、大きな利益をもたらしていません 29。UCOM の悪性腫瘍に対する特異性が高いため、これらの欠点は回避されます。UCOM である PCDHGB7 は、正常サンプルから高悪性度扁平上皮内病変 (HSIL) と子宮頸がん、および低悪性度扁平上皮内病変 (LSIL) を効率的に区別しますが、他のほとんどのバイオマーカーは子宮頸がんと正常サンプルしか区別できません 30。PCDHGB7 では正常子宮内膜と子宮内膜過形成の間に有意な差は検出されませんが、正常子宮内膜と異型増殖の間には有意な差が検出され、PCDHGB731 に基づくと正常子宮内膜と子宮内膜がん (EC) の間にはさらに大きな差が検出されます。UCOM は、データベースおよび臨床サンプル内の悪性病変に特有のものです。患者の観点から見ると、独自の UCOM は、さまざまなパフォーマンスの悪い不安定なバイオマーカーの複雑な兆候を理解するための閾値と、評価プロセス中の対応する不安を軽減します。臨床医の観点から見ると、独自の UCOM が悪性病変と良性病変を区別するため、患者のトリアージに役立ち、不必要な医療処置や過剰治療が削減されます。したがって、独自の UCOM は医療システムの冗長性を削減し、システムの苦痛を軽減し、必要とする人々により多くの医療リソースを提供できるようにします。
図 1 DNA メチル化検出のための GPS ワークフローの概略図 25。灰色の線: 入力 DNA 配列。赤線: T4 DNA ポリメラーゼで処理した DNA、入力の 3' 末端のシトシンを 5'-メチルシトシンに置き換えます。青色の C と Me: メチル化シトシン。青色 C: 非メチル化シトシン。黄色T:チミン25。
全部かゼロか
UCOM はがん細胞にのみ存在し、ほぼすべてのがん細胞で安定して検出されます。HIST1H4F は、ほぼすべての腫瘍タイプで過剰メチル化されているが、正常なサンプルでは過剰メチル化されていないことが検証されました 27。同様に、PCDHGB7 および SIX6 もすべての腫瘍サンプルで過剰メチル化されているが、正常サンプルでは過剰メチル化されていないことが示されています 30-32。このユニークな特性により、検出限界と感度に関して UCOM のパフォーマンスが大幅に向上します。サンプル中で区別できる癌細胞はわずか 2% であり、UCOM は既存のほとんどのバイオマーカーよりもはるかに感度の高いバイオマーカーになります 30。結腸直腸癌の検出に使用されるバイオマーカーとして、KRAS 変異は結腸直腸癌症例の約 36% にのみ存在します。診断の可能性が低いことを示唆しています33。結腸直腸がんにおけるKRAS変異の有病率は低いため、他のバイオマーカーと組み合わせたKRASは制限されます。実際、バイオマーカーの組み合わせは最初は有望に見えるかもしれませんが、検出分析ではるかに大きなノイズが実証され、通常はより複雑な実験手順が必要になるため、常に満足のいく結果が得られるわけではありません。対照的に、PCDHGB7 およびその他の UCOM はすべてのがんに存在します。UCOM は、複雑なノイズキャンセリング分析プロセスを排除しながら、さまざまな種類のがんサンプル中のがん成分を最高の精度で検出します。豊富なサンプルからがんを検出することは難しくありませんが、少量のサンプルからがんを検出することは非常に困難です。UCOM は少量のがんを検出できます。
図 2 UCOM の特性。
病理学的変化に先行してがんを検出
UCOM は、病理学的変化の前の前癌段階で検出できます。エピジェネティックなバイオマーカーとして、UCOM 異常は表現型異常よりも早い段階で発生し、腫瘍形成、進行、転移全体にわたって検出可能です 34,35。UCOM の感度は時間の経過とともに向上し、早期がんおよび前がん病変の検出における UCOM のパフォーマンスが向上します。生検や細胞診に基づいて早期がんを検出することは、最も経験豊富な病理学者であっても困難な場合があります。膣鏡検査によって取得された単一の生検は、HSIL+ サンプルの 60.6% で陽性であると報告されています。感度を高めるには、複数の病変に対して追加の生検が必要です 36。対照的に、UCOM である PCDHGB7 は、HSIL+ サンプルに対して 82% の感度を持ち、生検やほとんどのバイオマーカーの感度を上回っています 30。メチル化マーカーである FAM19A4 は、CIN2+ に対して 69% の感度を持ち、これは細胞診と同様ですが、CIN1 と正常サンプルを区別することはできません 37。UCOM は、はるかに感度の高い早期検出バイオマーカーであることが示されています。経験に基づく病理医と比較して、UCOM は早期がんの検出感度に優れており、それががんの予後と生存率の改善に貢献しています 30。さらに、UCOM は、経験豊富な病理医が不足している領域でも利用できる検出プラットフォームを提供し、検出効率を大幅に向上させます。統一されたサンプリングと検出手順により、UCOM 検出は安定した解釈しやすい結果をもたらし、より少ない専門人材と医療リソースを必要とするスクリーニングプロトコルに適しています。
検出が簡単
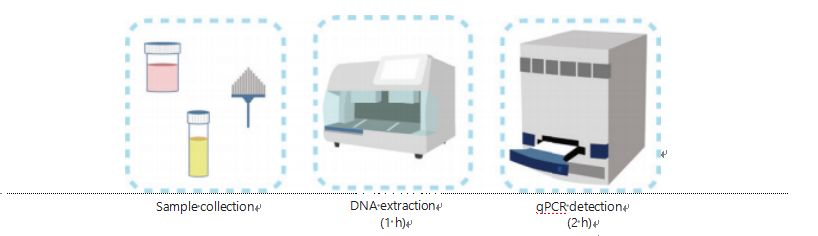
現在の DNA メチル化検出方法は複雑で時間がかかります。ほとんどのメソッドでは重亜硫酸塩変換が必要ですが、これによりサンプルの品質が低下し、結果が不安定で不正確になる可能性があります。亜硫酸水素塩治療によって引き起こされる再現性の悪さは、医師や患者に混乱をもたらし、さらに追跡調査や治療戦略を妨げる可能性があります。したがって、問題のあるサンプルの亜硫酸水素塩処理を回避し、臨床応用の要件に対応し、アクセシビリティを向上させるために、UCOM 検出方法をさらに修正しました。私たちは、メチル化感受性制限酵素とリアルタイム蛍光定量 PCR (Me-qPCR) を組み合わせて、簡単な操作手順で 3 時間以内に UCOM のメチル化状態を定量する新しい方法を開発しました (図 3)。Me-qPCR は、体液の臨床採取や自己採取の尿サンプルなど、複数の種類のサンプルに対応できます。収集された臨床サンプルは処理、保存され、標準化および自動化された DNA 抽出を使用した検出に簡単に進むことができます。抽出された DNA は、ワンポット反応のために Me-qPCR プラットフォームに直接適用され、定量結果が出力されます。特定のがんの種類に適合および検証された診断モデルを使用した簡単な結果分析の後、UCOM 検出結果の最終決定が解釈され、半定量的な値として表示されます。Me-qPCR プラットフォームは、EZ DNA メチル化ゴールド キットのプロトコルに従って、UCOM 検出において従来の重亜硫酸塩パイロシーケンスよりも優れた性能を発揮し、重亜硫酸塩変換にかかる時間を 3 時間節約します。革新的なメチル化検出プラットフォームにより、UCOM 検出がより安定し、より正確になり、よりアクセスしやすくなります30。
図 3 UCOM の検出プロセス。サンプルの種類には、専門的に採取された BALF、パップブラシ、および/または自己採取された尿が含まれます。DNA 抽出プロセスは自動抽出装置に適応させることができ、その生成物は qPCR によって直接検出できます。
UCOMの応用
肺癌
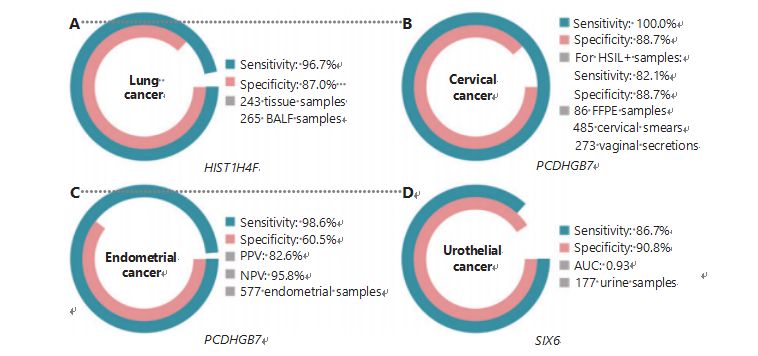
肺がんは世界で 2 番目に診断頻度が高く、致死率が最も高いがんであり、新規症例の 11.4%、新規死亡者の 18.0% を占めています1。すべての診断のうち、85% は非小細胞肺がん (NSCLC) であり、15% はより悪性度の高い小細胞肺がん (SCLC) です 38。低線量コンピュータ断層撮影 (LDCT) スキャンは、現在推奨されている肺がんのスクリーニング方法であり、早期発見を向上させ、死亡率を低下させることが示されています6。しかし、LDCT は、CEA39 などの他の一般的ながんマーカーと同様、特異性が低くアクセスしにくいため、まだ満足のいくスクリーニング方法として機能していません。LDCT スクリーニング戦略のコストと診断の見逃しおよび誤診の可能性が、肺がんスクリーニング推進の進歩を妨げています 40。UCOM である HIST1H4F は、気管支肺胞液 (BALF) サンプルの早期検出バイオマーカーとして大きな可能性を秘めています 27。HIST1H4F は肺腺癌および肺扁平上皮癌で過剰メチル化されており、検出特異性は 96.7%、感度は 87.0% (図 4A)、ステージ I の癌に対して優れた性能を示します 27。HIST1H4F は、NSCLC に対して 96.5% の特異性と 85.4% の感度を持ち、SCLC27 に対してそれぞれ 96.5% と 95.7% の感度を持ちます。さらに、膵臓がんや結腸直腸がんを含む他の 8 種類のがんのサンプルでは、8 種類すべてで HIST1H4F が過剰メチル化されていることが検証されました 27。
子宮頸癌
子宮頸がんは、2020 年に女性のがんとして 4 番目に多く診断され、がんによる死亡原因の 4 番目に多く、世界の新規症例の 3.1%、がん関連死亡の 3.4% を占めました1。WHOが提唱している2030年までに子宮頸がんを撲滅するには、子宮頸がんの早期発見が必要です。早期に発見された場合、浸潤子宮頸がんの 5 年生存率は 92% に達します41。米国癌協会(ACS)のガイドラインでは、スクリーニングのために子宮頸部細胞診検査、一次 HPV 検査、または同時検査を推奨しています 42。子宮頸部細胞診は侵襲的であり、CIN2+ 症例の 63.5% しか検出できません 37。
対照的に、PCDHGB7 はパプスメアと膣分泌物を使用するとはるかに優れたパフォーマンスを発揮し、超初期段階で HSIL と LSIL を効率的に区別できます。PCDHGB7 単独では、子宮頸がんに対して 100.0% の感度と 88.7% の特異度があり (図 4B)、HSIL+ サンプルに対しては 82.1% の感度と 88.7% の特異度があります 30。PCDHGB7 は、子宮頸がんの膣分泌物サンプルにおいて 90.9% の感度と 90.4% の特異性を有しており、採取がはるかに容易です 30。ハイリスク (hr)HPV 検査または Thinprep 細胞診検査 (TCT) と組み合わせると、PCDHGB7 の感度は 95.7%、特異度は 96.2% 向上し、hrHPV 検査 (20.3%)、TCT (51.2%) を大幅に上回りました。 )、子宮頸がんの場合は 2 つを組み合わせたもの(57.8%)30。PCDHGB7 は、TCGA データベースから 17 種類の癌において過剰メチル化されていることが示されており、UCOM ファミリーにおけるその適合性が示されています 30。
図 4 UCOM は大規模臨床研究で 4 種類のがんで検証されています。A. 508 サンプルの肺がん検出における UCOM である HIST1H4F のパフォーマンス。B. 844 サンプルの子宮頸がん検出における UCOM である PCDHGB7 のパフォーマンス。C. 577 個の子宮内膜 Pap および Tao ブラシ サンプルの子宮内膜がん検出における UCOM である PCDHGB7 のパフォーマンス。D. 177 サンプルの尿路上皮がん検出における UCOM である SIX6 のパフォーマンス。
EC
EC は、世界中で最も一般的な女性の生殖器系がんの 1 つであり、年間 420 万人が新たに発症し、がん関連死亡の 1% と推定されています1。早期段階で診断が成功すれば、EC は治癒可能であり、ステージ I のがんの 5 年生存率は 95% です。異常子宮出血などの症状のある患者は、最終的に EC43 を発症するのはわずか 5% ~ 10% であるにもかかわらず、定期的な臨床評価を受け、侵襲的で痛みを伴う生検処置を受けます。一般的な検出方法である経膣超音波は、子宮内膜の良性変化と悪性変化を区別できないことと、偽陽性率が高いため、信頼性が非常に低い44。
広く実施されている EC バイオマーカーである血清 CA-125 と PCDHGB7 の比較を並行して実施しました。血清 CA-125 の感度は 24.8% であり、これは CA-125 が 92.3% の特異性にもかかわらず EC の不適切なマーカーであることを示唆しています 31。Pap ブラシサンプルを使用した PCDHGB7 検出では、ECatall 段階の感度 80.65%、特異度 82.81% が得られましたが、Tao ブラシの感度は 61.29%、特異度 95.31% でした 31。Me-qPCR に基づく PCDHGB7 診断モデルは、Pap および Tao ブラシ サンプルを使用して、感度 98.61%、特異度 60.5%、全体の精度 85.5% をもたらしました (図 4C)。
尿路上皮がん
膀胱がん、腎盂がん、尿管がんからなる尿路上皮がんは、2020 年に世界で 7 番目に診断が多かったがんであり、新規症例の 5.2%、死亡の 3.9% を占めています1。尿路上皮がんはその 50% 以上が膀胱がんであり、2022 年に米国で 4 番目に多く診断されるがんとなり、新たに診断された症例の 11.6% を占めました3。膀胱がんの約 75% は、粘膜または粘膜下層に限定される非筋層浸潤性膀胱がんとして分類されます 45。膀胱鏡検査生検は、蛍光 in situ ハイブリダイゼーション (FISH) および細胞学検査によって実施される尿路上皮がん診断のゴールドスタンダードです。FISH と細胞診の診断性能は低く、膀胱鏡検査は煩雑であり、微小病変の見逃し、病変の誤った解釈、および癌の拡大または再発を引き起こす可能性があるという潜在的なリスクがあります 46。以前に検証された UCOM である PCDHGB7 も、尿路上皮がんにおいて過剰メチル化されており、曲線下面積が 0.86 であることが示されており、潜在的な診断能力が示唆されています 30。より多くの UCOM をさらに検証し、より多くのサンプル タイプに適切に対応するために、新しい UCOM である SIX6 が検査され、Me-qPCR プラットフォーム上の尿サンプルを使用した尿路上皮がんの早期検出において優れた診断可能性が示されました。尿サンプルを使用した SIX6 検出は、86.7% の競合感度と 90.8% の特異度を示しました (図 4D)。同時に、非侵襲的で取得が容易です 32。転移モニタリングおよび治療効果評価における SIX6 の可能性は現在調査中です。
将来と課題
UCOM は、複数のがんの診断の可能性において優れた性能を発揮しますが、やるべきことはまだたくさんあります。当社は UCOM のリストを拡大し、従来は検出が困難であったがんを含む、より多くの種類のがんにおいて UCOM を積極的に検証してきました。TCGA データベースからの検証結果は、より多くの種類の癌およびより多くの状況における UCOM の適用をさらに裏付けています。予備調査では、UCOM は現在のスクリーニング方法では初期段階で診断することがほぼ不可能である胆管癌および膵臓腺癌に対して強力な診断可能性を持っていることが示されています 32,47。UCOM による希少がんの検出機能は、改良されたリキッド バイオプシー プラットフォームによって循環腫瘍 DNA (ctDNA) とともに利用できます 48。血漿 DNA ベースの汎がん検出パネルを使用した研究では、57.9% の感度が得られました 49。高い特異性にもかかわらず、全体的なパフォーマンスはまだ改善の余地があることを示しています。
UCOM のユニークな特性は、治療効果の評価や再発モニタリングにおける UCOM の可能性の調査にも役立ちます。固形腫瘍の反応評価基準(RECIST)によれば、再発モニタリングと治療効果評価には医療画像が推奨される方法論である一方、評価には腫瘍マーカーが単独で使用されます50。しかし実際には、画像化アプローチは頻度とタイミングに大きく影響されるため、患者はより高いリスクとコストにさらされます 51,52。SIX6 は乳がん転移の予測因子として機能することが検証されています 32。リキッドバイオプシーベースの ctDNA モニタリングにより、放射線検査の数か月前に最小限の残存病変をリアルタイムで監視することが可能になり、理想的には再発に関連したがんの進行を遅らせて防止できます 53。予備的な結果は、UCOM が手術および治療直後の癌性の過剰メチル化のレベルをリアルタイムで反映していることを示唆しています 32。UCOM が示す高感度と複数の非侵入型サンプルへの適用性により、UCOM は患者の高いコンプライアンスを維持しながら、正確な再発モニタリングのバイオマーカーとして機能することができます。
同時に、テストへの一般のアクセスも大きな問題であり、さらなる努力が必要です。より多くの患者に利益をもたらすことを期待して、UCOM 検出協力がより多くの病院で採用される一方、中国の農村部では無償の検出とスクリーニングが積極的に行われています。UCOM が実行可能なスクリーニング ツールとして認定されるためには、特に開発途上地域においてアクセシビリティの向上が必要です。
UCOM のアプリケーションによる早期発見の結果は有望ですが、UCOM については不明な点も多くあります。積極的な調査により、UCOM ががんに普遍的に存在する理由について追加の研究が保証されます。UCOM の根底にあるエピジェネティックな制御機構はさらなる研究の価値があり、がん治療の新たな方向性を正当化する可能性があります。腫瘍の均一性と不均一性の間の相互作用に戻ると、特定の種類のがんに密接に関連するがんバイオマーカーの大部分において UCOM がなぜ例外となり得るのかに興味があります。UCOM によって同定された DNA メチル化異常が腫瘍形成、腫瘍進行、転移にどのような役割を果たしているかは、細胞の同一性の喪失と回復の過程で解明されておらず、徹底的な検査が必要である。もう1つの大きな関心は、逆の方法で癌痕跡の正確な検出と腫瘍組織起源の同定に近づくことを期待して、UCOMの均質形質を組織固有のマーカーに組み込む範囲にある。UCOM は、がんを予防し、がんを検出し、がんを防御して除去するための理想的なツールとなり得ます。
助成金支援
この研究は、中国国家重点研究開発プログラム (助成金番号 2022BEG01003)、中国国立自然科学財団 (助成金番号 32270645 および 32000505)、黒竜江省衛生委員会からの助成金 (助成金番号 2020-111) によって支援されました。 、菏沢科技研究院からの助成金(助成金番号2021KJPT07)。
利益相反に関する声明
Wei Li は、Shanghai Epiprobe Biotechnology Co., Ltd. の研究開発ディレクターです。Wenqiang Yu は、Epiprobe の科学諮問委員会の委員を務めています。W. Yu と Epiprobe は、この研究に関連する係属中の特許を承認しました。他のすべての著者は、競合する利益を宣言していません。
著者の寄稿
プロジェクトの発案とデザインを担当したのは Chengchen Qian と Wenqiang Yu です。
論文執筆者:チェンチェン・チェン。
イラスト制作:チェンチェン・キアン
原稿の査読と編集: Xiaolong Zou、Wei Li、yingshan Li、Wenqiang Yu。
参考文献
1. Sung H、Ferlay J、Siegel RL、LaversanneM、Soerjomataram I、Jemal A、他。2020 年の世界のがん統計: GLOBOCAN の推定値
185 か国における 36 種類のがんの全世界の罹患率と死亡率。CAがんJクリニック。2021年;71:209-49。
2. Xia C、Dong X、Li H、Cao M、Sun D、He S、他。2022 年の中国と米国のがん統計: プロファイル、傾向、決定要因。チン・メジェ(英語)。2022年;135:584-90。
3. シーゲル RL、ミラー KD、WagleNS、JemalA。がん統計、2023 年。CA Cancer J Clin。2023年;73:17-48。
4. クロスビー D、バティア S、ブリンドル KM、クッセンス LM、ダイブ C、エンバートン M、他。がんの早期発見。科学。2022年;375: eaay9040.
5. ラダバウム U、ドミニッツ JA、カヒ C、シェーン RE。の戦略
大腸がん検診。消化器科。2020年;158: 418-32。
6. タノウエ LT、タナー NT、グールド MK、シルベストリ GA。肺がん検診。Am J Respir Crit Care Med.2015年;191:19-33。
7. ブヴァール V、ウェンツェンセン N、マッキー A、バーコフ J、ブラザートン J、ジョルジ-ロッシ P、他。子宮頸がん検診に関する IARC の見解。N EnglJ Med.2021年;385: 1908-18。
8. Xue P、Ng MTA、QiaoY。LMIC における子宮頸がんスクリーニングのためのコルポスコピーの課題と人工知能によるソリューション。BMC医学。2020年;18:169
9. ジョンソン P、周 Q、ダオ DY、ロー YMD。肝細胞癌の診断と管理における循環バイオマーカー。Nat Rev 胃腸ロール ヘパトール。2022年;19:670-81。
10. Van PoppelH、Albreht T、Basu P、HogenhoutR、CollenS、Roobol M. 血清 PSA に基づくヨーロッパおよび世界の前立腺がんの早期検出: 過去、現在、未来。ナット・レヴ・ウロル。2022年;19:
562-72。
11. HolyoakeA、O'Sullivan P、Pollock R、Best T、Watanabe J、KajitaY、
他。膀胱移行上皮癌の検出と層別化のための多重 RNA 尿検査の開発。臨床がん研究所2008年;14:742-9。
12. Feinberg AP、Vogelstein B. 低メチル化は、一部のヒトの癌の遺伝子を正常な癌の遺伝子と区別します。自然。1983年;301: 89-92。
13. Ng JM、Yu J. 結腸直腸癌における潜在的なバイオマーカーとしての腫瘍抑制遺伝子のプロモーター過剰メチル化。IntJ Mol Sci.2015年;16: 2472-96。
14. Esteller M. がんエピゲノミクス: DNA メチロームとヒストン修飾マップ。ナット・レヴ・ジュネ。2007年;8: 286-98。
15. 西山 A、中西 M. がんの DNA メチル化状況をナビゲートする。トレンドジュネット。2021年;37:1012-27。
16. Xie W、Schultz MD、ListerR、Hou Z、Rajagopal N、Ray P、他。ヒト胚性幹細胞の多系統分化のエピゲノム解析。細胞。2013年;153:1134-48。
17. Li Y、Zheng H、Wang Q、Zhou C、WeiL、Liu X、他。ゲノムワイドな分析により、DNAメチル化バレーの低メチル化の促進におけるポリコームの役割が明らかになりました。ゲノムバイオル。2018年;19:18。
18. Koch A、JoostenSC、Feng Z、de Ruijter TC、DrahtMX、MelotteV、
他。がんにおける DNA メチル化の分析: 場所の再考。Nat Rev Clin Oncol。2018年;15:459-66。
19. KleinEA、Richards D、Cohn A、TummalaM、Lapham R、Cosgrove D、他。独立した検証セットを使用した、標的メチル化に基づく多癌早期検出テストの臨床検証。アン・オンコル。2021年;32: 1167-77。
20. ハナハン D、ワインバーグ RA。がんの特徴。細胞。2000年;100:57-70。
21. Hanahan D. がんの特徴: 新たな次元。がんの発見。2022年;12:31-46。
22. Schwartzberg L、Kim ES、Liu D、Schrag D. 精密腫瘍学: 誰が、どのように、何を、いつ、いつそうでないのか?Am Soc Clin Oncol Educ Book。2017: 160-9。
23. Liu H、Meng X、Wang J. リアルタイム定量的メチル化
子宮頸がん検診におけるPAX1遺伝子の検出。IntJ 婦人科がん。2020年;30: 1488-92。
24. インペリアーレ TF、ランソホフDF、イツコヴィッツ SH、レビン TR、ラビン P、リドガード GP、他結腸直腸がんスクリーニングのためのマルチターゲット便 DNA 検査。N EnglJ Med.2014年;370: 1287-97。
25. Li J、Li Y、Li W、Luo H、Xi Y、Dong S、他。ガイドの位置決め
配列決定により、細胞のアイデンティティと腫瘍免疫監視ネットワークを変化させる異常な DNA メチル化パターンが特定されます。ゲノム
解像度2019年;29:270-80。
26. Gao Q、LinYP、Li BS、Wang GQ、Dong LQ、Shen BY、他。循環無細胞 DNA メチル化シーケンス (THUNDER) による非侵入型複数癌検出: 開発および独立した検証研究。アン・オンコル。2023年;34:486-95。
27. Dong S、Li W、Wang L、Hu J、Song Y、Zhang B、他肺がんではヒストン関連遺伝子が過剰にメチル化されており、過剰にメチル化されている
HIST1H4F は、汎がんバイオマーカーとして機能する可能性があります。がん研究所2019年;79:6101-12。
28. HeijnsdijkEA、Wever EM、AuvinenA、Hugosson J、Ciatto S、Nelen V、他。前立腺特異抗原スクリーニングによる生活の質への影響。N EnglJ Med.2012年;367: 595-605。
29. LuzakA、Schnell-Inderst P、Bühn S、Mayer-Zitorosa A、Siebert U. 自費医療サービスとして提供されるがんスクリーニングバイオマーカー検査の臨床的有効性:系統的レビュー。Eur J 公衆衛生。2016年;26: 498-505。
30. Dong S、Lu Q、Xu P、Chen L、Duan X、Mao Z、他。
普遍的な癌のみのマーカーとしての過剰メチル化 PCDHGB7 とその早期子宮頸癌スクリーニングへの応用。臨床翻訳医学。2021年;11: e457。
31. Yuan J、Mao Z、Lu Q、Xu P、Wang C、Xu X、他。子宮内膜ブラシサンプルおよび子宮頸部擦過物における子宮内膜癌の早期検出のためのバイオマーカーとしての高度メチル化 PCDHGB7。フロントモルバイオシス。2022年;8: 774215。
32. Dong S、Yang Z、Xu P、Zheng W、Zhang B、Fu F、他。互いに
前癌段階および転移出現追跡のための過剰メチル化を伴う SIX6 上の排他的なエピジェネティック修飾。信号伝達ターゲットサー。2022年;7:208。
33. Huang L、Guo Z、Wang F、Fu L. KRAS 変異: 癌における治療不可能から治療可能へ。信号伝達ターゲット熱。2021年;6:386。
34. Belinsky SA、Nikula KJ、PalmisanoWA、MichelsR、SaccomannoG、GabrielsonE、他。p16(INK4a)の異常なメチル化は肺がんの初期に起こる現象であり、早期診断のための潜在的なバイオマーカーです。Proc Natl Acad Sci U SA.1998年;95:11891-6。
35. ロバートソン KD.DNA メチル化と人間の病気。ナット・レヴ・ジュネ。2005年;6: 597-610。
36.ウェンツェンセンN、ウォーカーJL、ゴールドMA、スミスKM、ズナレ、
マシューズ C ら。複数回の生検と膣鏡検査での子宮頸がん前駆体の検出。J クリン オンコル。2015年;33:83-9。
37. デ・ストルーパーLM、マイヤーCJ、ベルコフJ、ヘッセンリンクAT、スナイデルス
PJ、スティーンバーゲンRD、他。FAM19A4のメチル化解析
子宮頸部の擦り傷に含まれる遺伝子は子宮頸部の検出に非常に効率的です
癌腫および進行した CIN2/3 病変。Cancer Prev Res(フィラ)。2014年;7:1251-7。
38. タイ AA、ソロモン BJ、セクイスト LV、ゲイナー JF、ヘイスト RS。肺癌。ランセット。2021年;398: 535-54.
39. グルネット M、ソーレンセン JB。肺癌の腫瘍マーカーとしての癌胎児性抗原 (CEA)。肺癌。2012年;76:138-43。
40. Wood DE、KazerooniEA、Baum SL、EapenGA、EttingerDS、Hou L、他。肺がんスクリーニング、バージョン 3.2018、NCCN 腫瘍学臨床実践ガイドライン。J Natl Compr Canc Netw.2018年;16:412-41。
41. アメリカ癌協会。がんの事実と数字。米国ジョージア州アトランタ:米国癌協会。2023年 [2023年3月1日更新;2023年8月22日引用]。
42. FonthamETH、Wolf AMD、Church TR、EtzioniR、Fflowers CR、
Herzig A, et al.平均的なリスクを持つ個人に対する子宮頸がんスクリーニング: 米国癌協会による 2020 年のガイドラインの最新情報。CAがんJクリニック。2020年;70:321-46。
43. Clarke MA、Long BJ、Del Mar MorilloA、Arbyn M、Bakkum-Gamez JN、Wentzensen N. 女性における子宮内膜がんリスクと閉経後出血との関連: 体系的レビューとメタ分析。JAMAインターン医師。2018年;178: 1210-22.
44. ジェイコブズ I、ジェントリー=マハラジャ、バーネル M、マンチャンダ R、シン N、
シャルマ A ら。経膣超音波スクリーニングの感度
閉経後女性の子宮内膜がんに関する研究: UKCTOCS コホート内の症例対照研究。ランセット・オンコル。2011年;12:38-48。
45. BabjukM、Burger M、CompératEM、Gontero P、MostafidAH、
パロウJら筋層非浸潤性膀胱がん(TaT1 および上皮内がん)に関する欧州泌尿器科学会のガイドライン -
2019年のアップデート。エウロル。2019年;76:639-57。
46. アラゴン・チンJB。尿路上皮癌と膀胱癌の診断、生物学、治療における課題と進歩。ウロル・オンコル。2017年;35:462-4.
47. リズヴィ S、カーンSA、ハレマイヤー CL、ケリー RK、ゴアズ GJ。
胆管癌 – 進化する概念と治療戦略。Nat Rev Clin Oncol。2018年;15:95-111。
48. Ye Q、Ling S、Zheng S、Xu X. 肝細胞におけるリキッドバイオプシー
癌腫: 循環腫瘍細胞と循環腫瘍 DNA。モルガン。2019年;18:114
49. Zhang Y、Yao Y、Xu Y、Li L、Gong Y、Zhang K、他。汎がん
10,000人を超える中国人患者の循環腫瘍DNAの検出。ナットコミューン。2021年;12:11。
50. アイゼンハウアー EA、セラッセ P、ボガーツ J、シュワルツ LH、サージェント D、フォード R、他。固形腫瘍における新しい奏効評価基準: 改訂された RECIST ガイドライン (バージョン 1.1)。ユーロ J キャンサー。2009年;45:228-47。
51. リティエールS、コレットS、ド・フリースEG、シーモアL、ボガーツJ。RECIST - 過去から学び、未来を構築します。Nat Rev Clin Oncol。
2017年;14:187-92。
52. シーモア L、ボガーツ J、ペローネ A、フォード R、シュワルツ LH、マンドレカー S、他。iRECIST: 治験で使用する応答基準のガイドライン
免疫療法の検査。ランセット・オンコル。2017年;18: e143-52。
53. PantelK、Alix-Panabières C. リキッドバイオプシーと最小限の残存病変 – 最新の進歩と治療への影響。Nat Rev Clin Oncol。2019年;16:409-24。
この記事を次のように引用します: Qian C、Zou X、Li W、Li Y、Yu W。がんに対する前哨基地: ユニバーサルがんのみのマーカー。がん生物医学。2023年;20: 806-815。
土井: 10.20892/j.issn.2095-3941.2023.0313
投稿時刻: 2024 年 5 月 7 日